Алюминий — Википедия
| Алюминий | |
|---|---|
| ← Магний | Кремний → | |
| мягкий, лёгкий и пластичный металл серебристо-белого цвета. | |
 Алюминий | |
| Название, символ, номер | Алюминий / Aluminium (Al), 13 |
| Группа, период, блок | 13, 3, |
| Атомная масса (молярная масса) | 26,9815386(8)[1] а. е. м. (г/моль) |
| Электронная конфигурация | [Ne] 3s2 3p1 |
| Электроны по оболочкам | 2, 8, 3 |
| Радиус атома | 143 пм |
| Ковалентный радиус | 121 ± 4 пм |
| Радиус Ван-дер-Ваальса | 184 пм |
| Радиус иона | 51 (+3e) пм |
| Электроотрицательность | 1,61 (шкала Полинга) |
| Электродный потенциал | −1,66 В |
| Степени окисления | 0; +3 |
| Энергия ионизации | 1‑я: 577,5 (5,984) кДж/моль (эВ) 2‑я: 1816,7 (18,828) кДж/моль (эВ) |
| Термодинамическая фаза | Твёрдое вещество |
| Плотность (при н. у.) | 2,6989 г/см³ |
| Температура плавления | 660 °C, 933,5 K |
| Температура кипения | 2518,82 °C, 2792 K |
| Уд. теплота плавления | 10,75 кДж/моль |
| Уд. теплота испарения | 284,1 кДж/моль |
| 24,35[2] 24,2[3] Дж/(K·моль) | |
| Молярный объём | 10,0 см³/моль |
| Структура решётки | кубическая гранецентрированая |
| Параметры решётки | 4,050 Å |
| Температура Дебая | 394 K |
| Теплопроводность | (300 K) 237 Вт/(м·К) |
| Скорость звука | 5200 м/с |
| Номер CAS | 7429-90-5 |
| 13 | Алюминий |
Алюми́ний (Al, лат. aluminium) — элемент 13-й группы периодической таблицы химических элементов (по устаревшей классификации — элемент главной подгруппы III группы), третьего периода, с атомным номером 13. Относится к группе лёгких металлов. Наиболее распространённый металл и третий по распространённости химический элемент в земной коре (после кислорода и кремния).
Простое вещество алюминий — лёгкий парамагнитный металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Алюминий обладает высокой тепло- и электропроводностью, стойкостью к коррозии за счёт быстрого образования прочных оксидных плёнок, защищающих поверхность от дальнейшего взаимодействия.
Название элемента образовалось от лат. alumen — квасцы[4].
Впервые алюминий был получен датским физиком Гансом Эрстедом в 1825 году. Он восстановил хлорид этого элемента амальгамой калия при нагревании и выделил металл. Позже способ Эрстеда был улучшен Фридрихом Вёлером, он использовал для восстановления хлорида алюминия до металла чистый металлический калий и он же описал химические свойства алюминия.
Впервые полупромышленным способом алюминий получил в 1854 г. Сент-Клер Девиль по методу Вёлера, заменив калий на более безопасный натрий. Год спустя на Парижской выставке 1855 г. он продемонстрировал слиток металла, а в 1856 г. получил алюминий электролизом расплава двойной соли хлорида алюминия-натрия.
До развития широкомасштабного промышленного электролитического способа получения алюминия из глинозема этот металл был дороже золота. В 1889 году британцы, желая почтить богатым подарком русского химика Д. И. Менделеева, подарили ему аналитические весы, у которых чашки были изготовлены из золота и алюминия[5][6].
В России алюминий назвали в то время «серебром из глины», так как главной составной частью глины является глинозём Al2O3. Промышленный способ получения металла электролизом расплава Al
Соединения алюминия, например, двойная соль алюминия и калия — квасцы KAl(SO4)2 • 12H2O — известны и использовались с глубокой древности.
Распространённость[править | править код]
По распространённости в земной коре занимает 1-е место среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию. Массовая концентрация алюминия в земной коре, по данным различных исследователей, оценивается от 7,45 до 8,14 %[7].
Природные соединения алюминия[править | править код]
В природе алюминий, в связи с высокой химической активностью, встречается почти исключительно в виде соединений. Некоторые из природных минералов алюминия:
- Бокситы — Al2O3 · H2O (с примесями SiO2, Fe2O3, CaCO3)
- Нефелины — KNa3[AlSiO4]4
- Алуниты — (Na,K)2SO4·Al2(SO4)3·4Al(OH)3
- Глинозёмы (смеси каолинов с песком SiO2, известняком CaCO3, магнезитом MgCO3)
- Корунд (сапфир, рубин, наждак) — Al2O3
- Полевые шпаты — (K,Na)2O·Al2O3·6SiO2, Ca[Al2Si2O8]
- Каолинит — Al2
- Берилл (изумруд, аквамарин) — 3ВеО · Al2О3 · 6SiO2
- Хризоберилл (александрит) — BeAl2O4.
Тем не менее, в некоторых специфических восстановительных условиях (жерла вулканов) найдены ничтожные количества самородного металлического алюминия[8].
В природных водах алюминий содержится в виде малотоксичных химических соединений, например, фторида алюминия. Вид катиона или аниона зависит, в первую очередь, от кислотности водной среды. Концентрации алюминия в водоёмах России колеблются от 0,001 до 10 мг/л. В морской воде его концентрация 0,01 мг/л
Изотопы алюминия[править | править код]
Природный алюминий состоит практически полностью из единственного стабильного изотопа 27Al с ничтожными следами 26Al, наиболее долгоживущего радиоактивного изотопа с периодом полураспада 720 тыс. лет, образующегося в атмосфере при расщеплении ядер аргона 40Ar протонами космических лучей с высокими энергиями.
Алюминий образует прочную химическую связь с кислородом. По сравнению с другими металлами, восстановление алюминия до металла из природных оксидов и алюмосиликатов более сложно в связи с его высокой реакционной способностью и с высокой температурой плавления всех его руд, например таких, как бокситы, корунды.
Обычное восстановление до металла обжигом оксида с углеродом (как например, в металлургических процессах восстановления железа) — невозможно, так как сродство к кислороду у алюминия выше, чем у углерода.
Возможно получение алюминия посредством неполного восстановления алюминия с образованием промежуточного продукта — карбида алюминия Al4C3, который далее подвергается разложению при 1900—2000 °С с образованием металлического алюминия. Этот способ производства алюминия изучается, предполагается, что он более выгоден, чем классический электролитический способ производства алюминия процесс Холла — Эру[en], так как требует меньших энергозатрат и приводит к образованию меньшего количества CO
Современный метод получения, процесс Холла — Эру[en], был разработан независимо американцем Чарльзом Холлом и французом Полем Эру в 1886 году. Он заключается в растворении оксида алюминия Al2O3 в расплаве криолита Na3AlF6 с последующим электролизом с использованием расходуемых коксовых или графитовых анодных электродов. Такой метод получения требует очень больших затрат электроэнергии и поэтому получил промышленное применение только в XX веке.
Электролиз в расплаве криолита:
- 2Al2O3→Na3[AlF6]4Al+3O2{\displaystyle {\mathsf {2Al_{2}O_{3}{\xrightarrow {Na_{3}[AlF_{6}]}}4Al+3O_{2}}}}
Для производства 1000 кг чернового алюминия требуется 1920 кг глинозёма, 65 кг криолита, 35 кг фторида алюминия, 600 кг анодных графитовых электродов и около 17 МВт·ч электроэнергии (~61 ГДж)
Лабораторный способ получения алюминия предложил Фридрих Вёлер в 1827 году восстановлением металлическим калием безводного хлорида алюминия (реакция протекает при нагревании без доступа воздуха):
- AlCl3+3K→3KCl+Al{\displaystyle {\mathsf {AlCl_{3}+3K\rightarrow 3KCl+Al}}}
- Металл серебристо-белого цвета, лёгкий
- плотность — 2712 кг/м³
- температура плавления у технического алюминия — 658 °C, у алюминия высокой чистоты — 660 °C
- удельная теплота плавления — 390 кДж/кг
- температура кипения — 2518,8 °C
- удельная теплота испарения — 10,53 МДж/кг
- удельная теплоёмкость — 897 Дж/кг·K[3]
- временное сопротивление литого алюминия — 10—12 кг/мм², деформируемого — 18—25 кг/мм², сплавов — 38—42 кг/мм²
- Твёрдость по Бринеллю — 24—32 кгс/мм²
- высокая пластичность: у технического — 35 %, у чистого — 50 %, прокатывается в тонкий лист и даже фольгу
- Модуль Юнга — 70 ГПа
- Коэффициент Пуассона — 0,34
- Алюминий обладает высокой электропроводностью (37·106См/м — 65 % от электропроводности меди) и теплопроводностью (203,5 Вт/(м·К)), обладает высокой светоотражательной способностью.
- Слабый парамагнетик.
- Температурный коэффициент линейного расширения 24,58⋅10−6 К−1 (20—200 °C).
- Удельное сопротивление 0,0262—0,0295 Ом·мм²/м
- Температурный коэффициент электрического сопротивления 4,3⋅10−3 K−1. Алюминий переходит в сверхпроводящее состояние при температуре 1,2 кельвина.
Алюминий образует сплавы почти со всеми металлами. Наиболее известны сплавы с медью и магнием (дюралюминий) и кремнием (силумин).
Гидроксид алюминияПри нормальных условиях алюминий покрыт тонкой и прочной оксидной плёнкой и потому не реагирует с классическими окислителями: с O2, HNO3 (без нагревания), H2SO4(конц), но легко реагирует с HCl и H2SO4(разб). Благодаря этому алюминий практически не подвержен коррозии и потому широко востребован современной промышленностью. Однако при разрушении оксидной плёнки (например, при контакте с растворами солей аммония NH4+, горячими щелочами или в результате амальгамирования), алюминий выступает как активный металл-восстановитель. Не допустить образования оксидной плёнки можно, добавляя к алюминию такие металлы, как галлий, индий или олово. При этом поверхность алюминия смачивают легкоплавкие эвтектики на основе этих металлов[12].
Легко реагирует с простыми веществами:
- 4Al+3O2→2Al2O3{\displaystyle {\mathsf {4Al+3O_{2}\rightarrow 2Al_{2}O_{3}}}}
- 2Al+3Hal2→2AlHal3(Hal=Cl,Br,I){\displaystyle {\mathsf {2Al+3Hal_{2}\rightarrow 2AlHal_{3}(Hal=Cl,Br,I)}}}
- 2Al+3F2→2AlF3{\displaystyle {\mathsf {2Al+3F_{2}\rightarrow 2AlF_{3}}}}
- 2Al+3S→Al2S3{\displaystyle {\mathsf {2Al+3S\rightarrow Al_{2}S_{3}}}}
- 2Al+N2→2AlN{\displaystyle {\mathsf {2Al+N_{2}\rightarrow 2AlN}}}
ru.wikipedia.org
физические свойства, получение, применение, история :: ТОЧМЕХ
Физические свойства алюминия
Алюминий — мягкий, легкий, серебристо-белый металл с высокой тепло- и электропроводностью. Температура плавления 660°C.
По распространенности в земной коре алюминий занимает 3-е место после кислорода и кремния среди всех атомов и 1-е место — среди металлов.
К достоинствам алюминия и его сплавов следует отнести его малую плотность (2,7 г/см3), сравнительно высокие прочностные характеристики, хорошую тепло- и электропроводность, технологичность, высокую коррозионную стойкость. Совокупность этих свойств позволяет отнести алюминий к числу важнейших технических материалов.
Алюминий и его сплавы делятся по способу получения на деформируемые, подвергаемые обработке давлением и литейные, используемые в виде фасонного литья; по применению термической обработки — на термически не упрочняемые и термически упрочняемые, а также по системам легирования.
Получение
Впервые алюминий был получен Гансом Эрстедом в 1825 году. Современный метод получения разработали независимо друг от друга американец Чарльз Холл и француз Поль Эру. Он заключается в растворении оксида алюминия Al2O3 в расплаве криолита Na3AlF6 с последующим электролизом с использованием графитовых электродов. Такой метод получения требует больших затрат электроэнергии, и поэтому оказался востребован только в XX веке.
Применение
Алюминий широко применяется как конструкционный материал. Основные достоинства алюминия в этом качестве — легкость, податливость штамповке, коррозионная стойкость (на воздухе алюминий мгновенно покрывается прочной пленкой Al2O3, которая препятствует его дальнейшему окислению), высокая теплопроводность, неядовитость его соединений. В частности, эти свойства сделали алюминий чрезвычайно популярным при производстве кухонной посуды, алюминиевой фольги в пищевой промышленности и для упаковки.
Основной недостаток алюминия как конструкционного материала — малая прочность, поэтому его обычно сплавляют с небольшим количеством меди и магния (сплав называется дюралюминий).
Электропроводность алюминия сравнима с медью, при этом алюминий дешевле. Поэтому он широко применяется в электротехнике для изготовления проводов, их экранирования и даже в микроэлектронике при изготовлении проводников в чипах. Правда, у алюминия как электротехнического материала есть неприятное свойство — из-за прочной оксидной пленки его тяжело паять.
Благодаря комплексу свойств широко распространен в тепловом оборудовании.
Внедрение алюминиевых сплавов в строительстве уменьшает металлоемкость, повышает долговечность и надежность конструкций при эксплуатации их в экстремальных условиях (низкая температура, землетрясение и т.п.).
Алюминий находит широкое применение в различных видах транспорта. На современном этапе развития авиации алюминиевые сплавы являются основными конструкционными материалами в самолетостроении. Алюминий и сплавы на его основе находят все более широкое применение в судостроении. Из алюминиевых сплавов изготовляют корпусы судов, палубные надстройки, коммуникацию и различного рода судовое оборудование.
Идут исследования по разработке пенистого алюминия как особо прочного и легкого материала.
Драгоценный алюминий
В настоящее время алюминий является одним из самых популярных и нашедших широкое применение металлов. С самого момента открытия в середине XIX века его считали одним из ценнейших благодаря удивительным качествам: белый как серебро, легкий по весу и не подверженный воздействию окружающей среды. Стоимость его была выше цен на золото. Не удивительно, что в первую очередь алюминий нашел свое применение в создании ювелирных изделий и дорогих декоративных элементов.
В 1855 г. на Универсальной выставке в Париже алюминий был самой главной достопримечательностью. Изделия из алюминия располагались в витрине, соседствующей с бриллиантами французской короны. Постепенно зародилась определенная мода на алюминий. Его считали благородным малоизученным металлом, используемым исключительно для создания произведений искусства.
Наиболее часто алюминий использовали ювелиры. При помощи особой обработки поверхности ювелиры добивались наиболее светлого цвета металла, из-за чего его часто приравнивали к серебру. Но в сравнении с серебром, алюминий обладал более мягким блеском, чем обуславливалась еще большая любовь к нему ювелиров.
Так как химические и физические свойства алюминия сначала были слабо изучены, ювелиры сами изобретали новые техники его обработки. Алюминий технически легко обрабатывать, этот мягкий металл позволяет создавать отпечатки любых узоров, наносить рисунки и создавать желаемой формы изделия. Алюминий покрывался золотом, полировался и доводился до матовых оттенков.
Но со временем алюминий стал падать цене. Если в 1854-1856 годах стоимость одного килограмма алюминия составляла 3 тысячи старых франков, то в середине 1860-х годов за килограмм этого металла давали уже около ста старых франков. Впоследствии из-за низкой стоимости алюминий вышел из моды.
В настоящее время самые первые алюминиевые изделия представляют большую редкость. Большинство из них не пережило обесценивания металла и было заменено серебром, золотом и другими драгоценными металлами и сплавами. В последнее время вновь наблюдается повышенный интерес к алюминию у специалистов. Этот металл стал темой отдельной выставки , организованной в 2000 году Музеем Карнеги в Питсбурге. Во Франции расположен Институт истории алюминия, который в частности занимается исследованием первых ювелирных изделий из этого металла.
В Советском союзе из алюминия делали общепитовские приборы, чайники и т.д. И не только. Первый советский спутник был выполнен из алюминиевого сплава. Другой потребитель алюминия — электротехническая промышленность: из него делаются провода высоковольтных линий передач, обмотки моторов и трансформаторов, кабели, цоколи ламп, конденсаторы и многие другие изделия. Кроме того, порошок алюминия применяют во взрывчатых веществах и твердом топливе для ракет, используя его свойство быстро воспламеняться: если бы алюминий не покрывался тончайшей оксидной пленкой, то мог бы вспыхивать на воздухе.
Последнее изобретение — пеноалюминий, т.н. «металлический поролон», которому предсказывают большое будущее.
tochmeh.ru
Алюминий — свойства, харакретистики, обзорная статья
 Алюминий – это пластичный и лёгкий металл белого цвета, покрытый серебристой матовой оксидной плёнкой. В периодической системе Д. И. Менделеева этот химический элемент обозначается, как Al (Aluminium) и находится в главной подгруппе III группы, третьего периода, под атомным номером 13. Купить алюминий вы можете на нашем сайте.
Алюминий – это пластичный и лёгкий металл белого цвета, покрытый серебристой матовой оксидной плёнкой. В периодической системе Д. И. Менделеева этот химический элемент обозначается, как Al (Aluminium) и находится в главной подгруппе III группы, третьего периода, под атомным номером 13. Купить алюминий вы можете на нашем сайте.
История открытия
В 16 веке знаменитый Парацельс сделал первый шаг к добыче алюминия. Из квасцов он выделил «квасцовую землю», которая содержала оксид неизвестного тогда металла. В 18 веке к этому эксперименту вернулся немецкий химик Андреас Маргграф. Оксид алюминия он назвал «alumina», что на латинском языке означает «вяжущий». На тот момент металл не пользовался популярностью, так как не был найден в чистом виде.
Долгие годы выделить чистый алюминий пытались английские, датские и немецкие учёные. В 1855 году в Париже на Всемирной выставке металл алюминий произвёл фурор. Из него делали только предметы роскоши и ювелирные украшения, так как металл был достаточно дорогим. В конце 19 века появился более современный и дешёвый метод получения алюминия. В 1911 году в Дюрене выпустили первую партию дюралюминия, названного в честь города. В 1919 из этого материала был создан первый самолёт.
Физические свойства
Металл алюминий характеризуется высокой электропроводностью, теплопроводностью, стойкостью к коррозии и морозу, пластичностью. Он хорошо поддаётся штамповке, ковке, волочению, прокатке. Алюминий хорошо сваривается различными видами сварки. Важным свойством является малая плотность около 2,7 г/см³. Температура плавления составляет около 660°С.
Механические, физико-химические и технологические свойства алюминия зависят от наличия и количества примесей, которые ухудшают свойства чистого металла. Основные естественные примеси – это кремний, железо, цинк, титан и медь.
По степени очистки различают алюминий высокой и технической чистоты. Практическое различие заключается в отличии коррозионной устойчивости к некоторым средам. Чем чище металл, тем он дороже. Технический алюминий используется для изготовления сплавов, проката и кабельно-проводниковой продукции. Металл высокой чистоты применяют в специальных целях.
По показателю электропроводности алюминий уступает только золоту, серебру и меди. А сочетание малой плотности и высокой электропроводности позволяет конкурировать в сфере кабельно-проводниковой продукции с медью. Длительный отжиг улучшает электропроводность, а нагартовка ухудшает.
Теплопроводность алюминия повышается с увеличением чистоты металла. Примеси марганца, магния и меди снижают это свойство. По показателю теплопроводности алюминий проигрывает только меди и серебру. Благодаря этому свойству металл применяется в теплообменниках и радиаторах охлаждения.
Алюминий обладает высокой удельной теплоёмкостью и теплотой плавления. Эти показатели значительно больше, чем у большинства металлов. Чем выше степень чистоты алюминия, тем больше он способен отражать свет от поверхности. Металл хорошо полируется и анодируется.
Алюминий имеет большое сродство к кислороду и покрывается на воздухе тонкой прочной плёнкой оксида алюминия. Эта плёнка защищает металл от последующего окисления и обеспечивает его хорошие антикоррозионные свойства. Алюминий обладает стойкостью к атмосферной коррозии, морской и пресной воде, практически не вступает во взаимодействия с органическими кислотами, концентрированной или разбавленной азотной кислотой.
Химические свойства
Алюминий — это достаточно активный амфотерный металл. При обычных условиях прочная оксидная плёнка определяет его стойкость. Если разрушить оксидную плёнку, алюминий выступает как активный металл-восстановитель. В мелкораздробленном состоянии и при высокой температуре металл взаимодействует с кислородом. При нагревании происходят реакции с серой, фосфором, азотом, углеродом, йодом. При обычных условиях металл взаимодействует с хлором и бромом. С водородом реакции не происходит. С металлами алюминий образует сплавы, содержащие интерметаллические соединения – алюминиды.
При условии очищения от оксидной пленки, происходит энергичное взаимодействие с водой. Легко протекают реакции с разбавленными кислотами. Реакции с концентрированной азотной и серной кислотой происходят при нагревании. Алюминий легко реагирует со щелочами. Практическое применение в металлургии нашло свойство восстанавливать металлы из оксидов и солей – реакции алюминотермии.
Получение
Алюминий находится на первом месте среди металлов и на третьем среди всех элементов по распространённости в земной коре. Приблизительно 8% массы земной коры составляет именно этот металл. Алюминий содержится в тканях животных и растений в качестве микроэлемента. В природе он встречается в связанном виде в форме горных пород, минералов. Каменная оболочка земли, находящаяся в основе континентов, формируется именно алюмосиликатами и силикатами.
Алюмосиликаты – это минералы, образовавшиеся в результате вулканических процессов в соответствующих условиях высоких температур. При разрушении алюмосиликатов первичного происхождения (полевые шпаты) сформировались разнообразные вторичные породы с более высоким содержанием алюминия (алуниты, каолины, бокситы, нефелины). В состав вторичных пород алюминий входит в виде гидроокисей или гидросиликатов. Однако не каждая алюминийсодержащая порода может быть сырьём для глинозёма – продукта, из которого при помощи метода электролиза получают алюминий.
Наиболее часто алюминий получают из бокситов. Залежи этого минерала распространены в странах тропического и субтропического пояса. В России также применяются нефелиновые руды, месторождения которых располагаются в Кемеровской области и на Кольском полуострове. При добыче алюминия из нефелинов попутно также получают поташ, кальцинированную соду, цемент и удобрения.
В бокситах содержится 40-60% глинозёма. Также в составе имеются оксид железа, диоксид титана, кремнезём. Для выделения чистого глинозёма используют процесс Байера. В автоклаве руду нагревают с едким натром, охлаждают, отделяют от жидкости «красный шлам» (твёрдый осадок). После осаждают гидроокись алюминия из полученного раствора и прокаливают её для получения чистого глинозёма. Глинозём должен соответствовать высоким стандартам по чистоте и размеру частиц.
Из добытой и обогащённой руды извлекают глинозём (оксид алюминия). Затем методом электролиза глинозём превращают в алюминий. Заключительным этапом является восстановление процессом Холла-Эру. Процесс заключается в следующем: при электролизе раствора глинозёма в расплавленном криолите происходит выделение алюминия. Катодом служит дно электролизной ванны, а анодом – угольные бруски, находящиеся в криолите. Расплавленный алюминий осаждается под раствором криолита с 3-5% глинозёма. Температура процесса поднимается до 950°С, что намного превышает температуру плавления самого алюминия (660°С). Глубокую очистку алюминия проводят зонной плавкой или дистилляцией его через субфторид.
Применение
Алюминий применяется в металлургии в качестве основы для сплавов (дуралюмин, силумин) и легирующего элемента (сплавы на основе меди, железа, магния, никеля). Сплавы алюминия используются в быту, в архитектуре и строительстве, в судостроении и автомобилестроении, а также в космической и авиационной технике. Алюминий применяется при производстве взрывчатых веществ. Анодированный алюминий (покрытый окрашенными плёнками из оксида алюминия) применяют для изготовления бижутерии. Также металл используется в электротехнике.
Рассмотрим, как используют различные изделия из алюминия.
Алюминиевая лента представляет собой тонкую алюминиевую полосу толщиной 0,3-2 мм, шириной 50-1250 мм, которая поставляется в рулонах. Используется лента в пищевой, лёгкой, холодильной промышленности для изготовления охлаждающих элементов и радиаторов.
Круглая алюминиевая проволока применяется для изготовления кабелей и проводов для электротехнических целей, а прямоугольная для обмоточных проводов.
Алюминиевые трубы отличаются долговечностью и стойкостью в условиях сельских и городских промышленных районов. Применяются они в отделочных работах, дорожном строительстве, конструкции автомобилей, самолётов и судов, производстве радиаторов, трубопроводов и бензобаков, монтаже систем отопления, магистральных трубопроводов, газопроводов, водопроводов.
Алюминиевые втулки характеризуются простотой в обработке, монтаже и эксплуатации. Используются они для концевого соединения металлических тросов.
Алюминиевый круг — это сплошной профиль круглого сечения. Используется это изделие для изготовления различных конструкций.
Алюминиевый пруток применяется для изготовления гаек, болтов, валов, крепежных элементов и шпинделей.
Около 3 мг алюминия каждый день поступает в организм человека с продуктами питания. Больше всего металла в овсянке, горохе, пшенице, рисе. Учёными установлено, что он способствует процессам регенерации, стимулирует развитие и рост тканей, оказывает влияние на активность пищеварительных желёз и ферментов.
Алюминиевый лист
Алюминиевая плита
Алюминиевые чушки
Алюминиевые уголки
Алюминиевая проволока
При использовании алюминиевой посуды в быту необходимо помнить, что хранить и нагревать в ней можно исключительно нейтральные жидкости. Если же в такой посуде готовить, к примеру, кислые щи, то алюминий поступит в еду, и она будет иметь неприятный «металлический» привкус.
Алюминий входит в состав лекарственных препаратов, используемых при заболеваниях почек и желудочно-кишечного тракта.
cu-prum.ru
Свойства алюминия и области применения в промышленности и быту
Федеральное агентство по образованию РФ
Государственный технологический университет
«Московский институт стали и сплавов»
Российская олимпиада школьников
«Инновационные технологии и материаловедение»
II-й этап: Научно-творческий конкурс
Направление (профиль):
«Материаловедение и технологии новых материалов»
РЕФЕРАТ
на тему:
«Свойства алюминия и области применения в промышленности и быту «
Работу выполнил:
Зайцев Виктор Владиславович
Москва, 2009
Содержание
1. Введение
1.1 Общее определение алюминия
1.2 История получения алюминия
2. Классификация алюминия по степени чистоты и его механические свойства
3. Основные легирующие элементы в алюминиевых сплавах и их функции
4. Применение алюминия и его сплавов в промышленности и быту
4.1 Авиация
4.2 Судостроение
4.3 Железнодорожный транспорт
4.4 Автомобильный транспорт
4.5 Строительство
4.6 Нефтяная и химическая промышленность
4.7 Алюминевая посуда
5. Заключение
5.1. Алюминий — материал будущего
6. Список используемой литературы
В своём реферате на тему ”Свойства алюминия и области применения в промышленности и быту” я хотел бы указать на особенность этого металла и его превосходство перед другими. Весь мой текст является доказательством того, что алюминий метал будущего и без него будет трудным наше дальнейшее развитие.
Алюминий ( лат. Aluminium, от alumen — квасцы) — химический элемент III гр. периодической системы, атомный номер 13, атомная масса 26,98154. Серебристо-белый металл, легкий, пластичный, с высокой электропроводностью, tпл = 660 °С. Химически активен (на воздухе покрывается защитной оксидной пленкой). По распространенности в природе занимает 3-е место среди элементов и 1-е среди металлов (8,8% от массы земной коры). По электропроводности алюминий — на 4-м месте, уступая лишь серебру (оно на первом месте), меди и золоту, что при дешевизне алюминия имеет огромное практическое значение. Алюминия вдвое больше, чем железа, и в 350 раз больше, чем меди, цинка, хрома, олова и свинца вместе взятых. Его плотность равна всего 2,7*103кг/м 3 . Алюминий имеет решётку гранецентрированного куба, устойчив при температурах от — 269 °С до точки плавления (660 °С). Теплопроводность составляет при 24°С 2,37 Вт×см-1 ×К-1 . Электросопротивление алюминия высокой чистоты (99,99%) при 20°С составляет 2,6548×10-8 Ом×м, или 65% электросопротивления международного эталона из отожжённой меди. Отражательная способность полированной поверхности составляет более 90%.
Документально зафиксированное открытие алюминия произошло в 1825. Впервые этот металл получил датский физик Ганс Христиан Эрстед, когда выделил его при действии амальгамы калия на безводный хлорид алюминия (полученный при пропускании хлора через раскаленную смесь оксида алюминия с углем). Отогнав ртуть, Эрстед получил алюминий, правда, загрязненный примесями. В 1827 немецкий химик Фридрих Вёлер получил алюминий в виде порошка восстановлением гексафторалюмината калием. Современный способ получения алюминия был открыт в 1886 молодым американским исследователем Чарльзом Мартином Холлом. (С 1855 до 1890 было получено лишь 200 тонн алюминия, а за следующее десятилетие по методу Холла во всем мире получили уже 28000т. этого металла) Алюминий чистотой свыше 99,99% впервые был получен электролизом в 1920г. В 1925 г. в работе Эдвардса опубликованы некоторые сведения о физических и механических свойствах такого алюминия. В 1938г. Тэйлор, Уиллей, Смит и Эдвардс опубликовали статью, в которой приведены некоторые свойства алюминия чистотой 99,996%, полученного во Франции также электролизом. Первое издание монографии о свойствах алюминия вышло в свет в 1967г. Еще недавно считалось, что алюминий как весьма активный металл не может встречаться в природе в свободном состоянии, однако в 1978г. в породах Сибирской платформы был обнаружен самородный алюминий — в виде нитевидных кристаллов длиной всего 0,5 мм (при толщине нитей несколько микрометров). В лунном грунте, доставленном на Землю из районов морей Кризисов и Изобилия, также удалось обнаружить самородный алюминий. Предполагают, что металлический алюминий может образоваться конденсацией из газа. При сильном повышении температуры галогениды алюминия разлагаются, переходя в состояние с низшей валентностью металла, например, AlCl. Когда при понижении температуры и отсутствии кислорода такое соединение конденсируется, в твердой фазе происходит реакция диспропорционирования: часть атомов алюминия окисляется и переходит в привычное трехвалентное состояние, а часть — восстанавливается. Восстановиться же одновалентный алюминий может только до металла: 3AlCl > 2Al + AlCl3 . В пользу этого предположения говорит и нитевидная форма кристаллов самородного алюминия. Обычно кристаллы такого строения образуются вследствие быстрого роста из газовой фазы. Вероятно, микроскопические самородки алюминия в лунном грунте образовались аналогичным способом.
В последующие годы благодаря сравнительной простоте получения и привлекательным свойствам опубликовано много работ о свойствах алюминия. Чистый алюминий нашёл широкое применение в основном в электронике — от электролитических конденсаторов до вершины электронной инженерии — микропроцессоров; в криоэлектронике, криомагнетике. Более новыми способами получения чистого алюминия являются метод зонной очистки, кристаллизация из амальгам (сплавов алюминия со ртутью) и выделение из щёлочных растворов. Степень чистоты алюминия контролируется величиной электросопротивления при низких температурах. В настоящее время используется следующая классификация алюминия по степени чистоты:
Механические свойства алюминия при комнатной температуре:
Чистый алюминий — довольно мягкий металл — почти втрое мягче меди, поэтому даже сравнительно толстые алюминиевые пластинки и стержни легко согнуть, но когда алюминий образует сплавы (их известно огромное множество), его твердость может возрасти в десятки раз. Наиболее широко применяются:
Бериллий добавляется для уменьшения окисления при повышенных температурах. Небольшие добавки бериллия (0,01 — 0,05%) применяют в алюминиевых литейных сплавах для улучшения текучести в производстве деталей двигателей внутреннего сгорания (поршней и головок цилиндров).
Бор вводят для повышения электропроводимости и как рафинирующую добавку. Бор вводится в алюминиевые сплавы, используемые в атомной энергетике (кроме деталей реакторов), т.к он поглощает нейтроны, препятствуя распространению радиации. Бор вводится в среднем в количестве 0,095 — 0,1%.
Висмут. Металлы с низкой температурой плавления, такие как висмут, свинец, олово, кадмий вводят в алюминиевые сплавы для улучшения обрабатываемости резанием. Эти элементы образуют мягкие легкоплавкие фазы, которые способствуют ломкости стружки и смазыванию резца.
Галлий добавляется в количестве 0,01 — 0,1% в сплавы, из которых далее изготавливаются расходуемые аноды.
Железо. В малых количествах (»0,04%) вводится при производстве проводов для увеличения прочности и улучшает характеристики ползучести. Так же железо уменьшает прилипание к стенкам форм при литье в кокиль.
Индий. Добавка 0,05 — 0,2% упрочняют сплавы алюминия при старении, особенно при низком содержании меди. Индиевые добавки используются в алюминиево-кадмиевых подшипниковых сплавах.
Примерно 0,3% кадмия вводят для повышения прочности и улучшения коррозионных свойств сплавов.
Кальций придаёт пластичность. При содержании кальция 5% сплав обладает эффектом сверхпластичности.
Кремний является наиболее используемой добавкой в литейных сплавах. В количестве 0,5 — 4% уменьшает склонность к трещинообразованию. Сочетание кремния с магнием делают возможным термоуплотнение сплава.
Магний. Добавка магния значительно повышает прочность без снижения пластичности, повышает свариваемость и увеличивает коррозионную стойкость сплава.
Медь упрочняет сплавы, максимальное упрочнение достигается при содержании меди 4 — 6%. Сплавы с медью используются в производстве поршней двигателей внутреннего сгорания, высококачественных литых деталей летательных аппаратов.
Олово улучшает обработку резанием.
Титан. Основная задача титана в сплавах — измельчение зерна в отливках и слитках, что очень повышает прочность и равномерность свойств во всём объёме.
Алюминий — один из самых распространенных и дешевых металлов. Без него трудно представить себе современную жизнь. Недаром алюминий называют металлом 20 века. Он хорошо поддается обработке: ковке, штамповке, прокату, волочению, прессованию. Чистый алюминий — довольно мягкий металл; из него делают электрические провода, детали конструкций, фольгу для пищевых продуктов, кухонную утварь и «серебряную» краску. Этот красивый и легкий металл широко используют в строительстве и авиационной технике. Алюминий очень хорошо отражает свет. Поэтому его используют для изготовления зеркал — методом напыления металла в вакууме.
mirznanii.com
Алюминий. Описание, свойства, происхождение и применение металла

Кусок чистого алюминия
Алюминий — очень редкий минерал семейства меди-купалита подкласса металлов и интерметаллидов класса самородных элементов. Преимущественно в виде микроскопических выделений сплошного мелкозернистого строения. Может образовывать пластинчатые или чешуйчатые кристаллы до 1 мм., отмечены нитевидные кристаллы длиной до 0,5 мм. при толщине нитей несколько мкм. Лёгкий парамагнитный металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке.
СТРУКТУРА
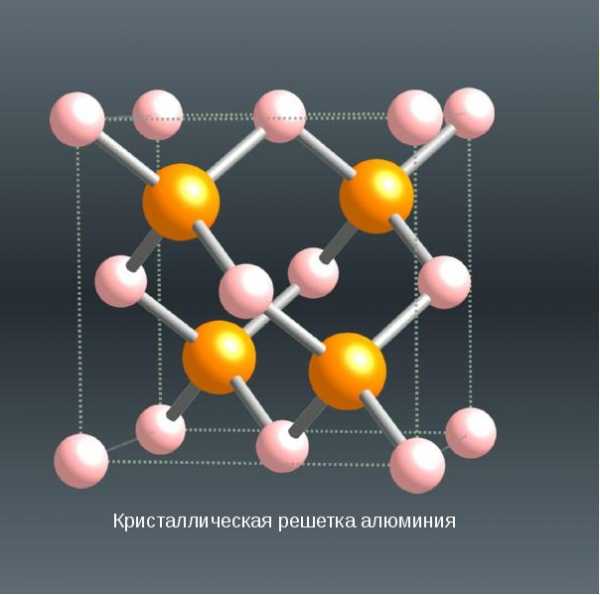
Кубическая гранецентрированная структура. 4 оранжевых атома
Кристаллическая решетка алюминия — гранецентрированный куб, которая устойчива при температуре от 4°К до точки плавления. В алюминии нет аллотропических превращений, т.е. его строение постоянно. Элементарная ячейка состоит из четырех атомов размером 4,049596×10-10 м; при 25 °С атомный диаметр (кратчайшее расстояние между атомами в решетке) составляет 2,86×10-10 м, а атомный объем 9,999×10-6 м3/г-атом.
Примеси в алюминии незначительно влияют на величину параметра решетки. Алюминий обладает большой химической активностью, энергия образования его соединений с кислородом, серой и углеродом весьма велика. В ряду напряжений он находится среди наиболее электроотрицательных элементов, и его нормальный электродный потенциал равен -1,67 В. В обычных условиях, взаимодействуя с кислородом воздуха, алюминий покрыт тонкой (2-10-5 см), но прочной пленкой оксида алюминия А1203, которая защищает от дальнейшего окисления, что обусловливает его высокую коррозионную стойкость. Однако при наличии в алюминии или окружающей среде Hg, Na, Mg, Ca, Si, Си и некоторых других элементов прочность оксидной пленки и ее защитные свойства резко снижаются.
СВОЙСТВА
Самородный алюминий. Поле зрения 5 x 4 мм. Азербайджан, Гобустанский район, Каспийское море, Хере-Зиря или остров Булла
Алюминий — мягкий, легкий, серебристо-белый металл с высокой тепло- и электропроводностью, парамагнетик. Температура плавления 660°C. К достоинствам алюминия и его сплавов следует отнести его малую плотность (2,7 г/см3), сравнительно высокие прочностные характеристики, хорошую тепло- и электропроводность, технологичность, высокую коррозионную стойкость. Совокупность этих свойств позволяет отнести алюминий к числу важнейших технических материалов. Он легко вытягивается в проволоку и прокатывается в тонкие листы. Алюминий химически активен (на воздухе покрывается защитной оксидной пленкой — оксидом алюминия.) надежно предохраняет металл от дальнейшего окисления. Но если порошок алюминия или алюминиевую фольгу сильно нагреть, то металл сгорает ослепительным пламенем, превращаясь в оксид алюминия. Алюминий растворяется даже в разбавленных соляной и серной кислотах, особенно при нагревании. А вот в сильно разбавленной и концентрированной холодной азотной кислоте алюминий не растворяется. При действии на алюминий водных растворов щелочей слой оксида растворяется, причем образуются алюминаты — соли, содержащие алюминий в составе аниона.
ЗАПАСЫ И ДОБЫЧА

Кусочки алюминия
По распространённости в земной коре Земли занимает 1-е место среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию. Массовая концентрация алюминия в земной коре, по данным различных исследователей, оценивается от 7,45 до 8,14%.
Современный метод получения, процесс Холла—Эру был разработан независимо американцем Чарльзом Холлом и французом Полем Эру в 1886 году. Он заключается в растворении оксида алюминия Al2O3 в расплаве криолита Na3AlF6 с последующим электролизом с использованием расходуемых коксовых или графитовых анодных электродов. Такой метод получения требует очень больших затрат электроэнергии, и поэтому получил промышленное применение только в XX веке.
ПРОИСХОЖДЕНИЕ

Аллюминий, агрегированный с коркой байерита на поверхности. Узбекистан, Навойская область, Учкудук
Вследствие высокой химической активности он не встречается в чистом виде, а лишь в составе различных соединений. Так, например, известно множество руд, минералов, горных пород, в состав которых входит алюминий. Однако добывается он только из бокситов, содержание которых в природе не слишком велико. Самые распространенные вещества, содержащие рассматриваемый металл: полевые шпаты; бокситы; граниты; кремнезем; алюмосиликаты; базальты и прочие. В небольшом количестве алюминий обязательно входит в состав клеток живых организмов. Некоторые виды плаунов и морских обитателей способны накапливать этот элемент внутри своего организма в течение жизни.
ПРИМЕНЕНИЕ

Украшение из алюминия
Широко применяется как конструкционный материал. Основные достоинства алюминия в этом качестве — лёгкость, податливость штамповке, коррозионная стойкость. Электропроводность алюминия всего в 1,7 раза меньше, чем у меди, при этом алюминий приблизительно в 4 раза дешевле за килограмм, но, за счёт в 3,3 раза меньшей плотности, для получения равного сопротивления его нужно приблизительно в 2 раза меньше по весу. Поэтому он широко применяется в электротехнике для изготовления проводов, их экранирования и даже в микроэлектронике при напылении проводников на поверхности кристаллов микросхем.
Когда алюминий был очень дорог, из него делали разнообразные ювелирные изделия. Так, Наполеон III заказал алюминиевые пуговицы, а Менделееву в 1889 г. были подарены весы с чашами из золота и алюминия. Мода на ювелирные изделия из алюминия сразу прошла, когда появились новые технологии его получения, во много раз снизившие себестоимость. Сейчас алюминий иногда используют в производстве бижутерии.
Алюминий (англ. Aluminium) — Al
| Молекулярный вес | 26.98 г/моль |
| Происхождение названия | от латинского alumen |
| IMA статус | утверждён в 1978 |
КЛАССИФИКАЦИЯ
Hey’s CIM Ref1.21
| Strunz (8-ое издание) | 1/A.03-05 |
| Nickel-Strunz (10-ое издание) | 1.AA.05 |
| Dana (7-ое издание) | 1.1.22.1 |
| Dana (8-ое издание) | 1.1.1.5 |
ФИЗИЧЕСКИЕ СВОЙСТВА
| Цвет минерала | серовато-белый, белый |
| Прозрачность | непрозрачный |
| Блеск | металлический |
| Спайность | нет |
| Твердость (шкала Мооса) | 2-3 |
| Прочность | ковкий |
| Плотность (измеренная) | 2.7 г/см3 |
| Радиоактивность (GRapi) | 0 |
ОПТИЧЕСКИЕ СВОЙСТВА
Плеохроизмне плеохроирует
| Тип | изотропный |
| Люминесценция в ультрафиолетовом излучении | не флюоресцентный |
| Магнетизм | парамагнетик |
КРИСТАЛЛОГРАФИЧЕСКИЕ СВОЙСТВА
| Точечная группа | (4/m 3 2/m) — изометричная гексаоктаэдральная |
| Пространственная группа | F m3m, P m3m |
| Сингония | кубическая |
| Параметры ячейки | a = 4.04Å |
Интересные статьи:
mineralpro.ru 26.07.2016mineralpro.ru
Алюминий — Мегаэнциклопедия Кирилла и Мефодия — статья
Радиус нейтрального атома алюминия 0, 143 нм, радиус иона Al3+ 0, 057 нм. Энергии последовательной ионизации нейтрального атома алюминия равны, соответственно, 5, 984, 18, 828, 28, 44 и 120 эВ. По шкале Полинга электроотрицательность алюминия 1, 5.
Простое вещество алюминий — мягкий легкий серебристо-белый металл.
Латинское aluminium происходит от латинского же alumen, означающего квасцы (сульфат алюминия и калия KAl(SO4)2·12H2O), которые издавна использовались при выделке кож и как вяжущее средство. Из-за высокой химической активности открытие и выделение чистого алюминия растянулось почти на 100 лет. Вывод о том, что из квасцов может быть получена «земля» (тугоплавкое вещество, по-современному — оксид алюминия) сделал еще в 1754 немецкий химик А. Маргграф. Позднее оказалось, что такая же «земля» может быть выделена из глины, и ее стали называть глиноземом. Получить металлический алюминий смог только в 1825 датский физик Х. К. Эрстед. Он обработал амальгамой калия (сплавом калия со ртутью) хлорид алюминия AlCl3, который можно было получить из глинозема, и после отгонки ртути выделил серый порошок алюминия.Только через четверть века этот способ удалось немного модернизировать. Французский химик А. Э. Сент-Клер Девиль в 1854 предложил использовать для получения алюминия металлический натрий, и получил первые слитки нового металла. Стоимость алюминия была тогда очень высока, и из него изготовляли ювелирные украшения.Промышленный способ производства алюминия путем электролиза расплава сложных смесей, включающих оксид, фторид алюминия и другие вещества, независимо друг от друга разработали в 1886 году П. Эру (Франция) и Ч. Холл (США). Производство алюминия связано с высоким расходом электроэнергии, поэтому в больших масштабах оно было реализовано только в 20 веке. В Советском Союзе первый промышленный алюминий был получен 14 мая 1932 года на Волховском алюминиевом комбинате, построенном рядом с Волховской гидроэлектростанцией.По распространенности в земной коре алюминий занимает первое место среди металлов и третье место среди всех элементов (после кислорода и кремния), на его долю приходится около 8, 8% массы земной коры. Алюминий входит в состав огромного числа минералов, главным образом, алюмосиликатов, и горных пород. Соединения алюминия содержат граниты, базальты, глины, полевые шпаты и др. Но вот парадокс: при огромном числе минералов и пород, содержащих алюминий, месторождения бокситов — главного сырья при промышленном получении алюминия, довольно редки. В России месторождения бокситов имеются в Сибири и на Урале. Промышленное значение имеют также алуниты и нефелины.В качестве микроэлемента алюминий присутствует в тканях растений и животных. Существуют организмы-концентраторы, накапливающие алюминий в своих органах, — некоторые плауны, моллюски.
При промышленном производстве бокситы сначала подвергают химической переработке, удаляя из них примеси оксидов кремния и железа и других элементов. В результате такой переработки получают чистый оксид алюминия Al2O3 — основное сырье при производстве металла электролизом. Однако из-за того, что температура плавления Al2O3 очень высока (более 2000 °C), использовать его расплав для электролиза не удается.
Выход ученые и инженеры нашли в следующем. В электролизной ванне сначала расплавляют криолит Na3AlF6 (температура расплава немного ниже 1000 °C). Криолит можно получить, например, при переработке нефелинов Кольского полуострова. Далее в этот расплав добавляют немного Al2О3 (до 10 % по массе) и некоторые другие вещества, улучающие условия проведения последующего процесса. При электролизе этого расплава происходит разложение оксида алюминия, криолит остается в расплаве, а на катоде образуется расплавленный алюминий:2Al2О3 = 4Al + 3О2.
Так как анодом при электролизе служит графит, то выделяющийся на аноде кислород реагирует с графитом и образуется углекислый газ СО2.
При электролизе получают металл с содержанием алюминия около 99, 7%. В технике применяют и значительно более чистый алюминий, в котором содержание этого элемента достигает 99, 999% и более.
Алюминий — типичный металл, кристаллическая решетка кубическая гранецентрированная, параметр а = 0, 40403 нм. Температура плавления чистого металла 660 °C, температура кипения около 2450 °C, плотность 2, 6989 г/см3. Температурный коэффициент линейного расширения алюминия около 2, 5·10-5 К-1. Стандартный электродный потенциал Al3+/Al –1, 663В.
Химически алюминий — довольно активный металл. На воздухе его поверхность мгновенно покрывается плотной пленкой оксида Al2О3, которая препятствует дальнейшему доступу кислорода к металлу и приводит к прекращению реакции, что обусловливает высокие антикоррозионные свойства алюминия. Защитная поверхностная пленка на алюминии образуется также, если его поместить в концентрированную азотную кислоту.
С остальными кислотами алюминий активно реагирует:
6НСl + 2Al = 2AlCl3 + 3H2,
3Н2SO4 + 2Al = Al2(SO4)3 + 3H2.
Алюминий реагирует с растворами щелочей. Сначала растворяется защитная оксидная пленка:
Al2О3 + 2NaOH + 3H2O = 2Na[Al(OH)4].
Затем протекают реакции:
2Al + 6H2O = 2Al(OH)3 + 3H2,
NaOH + Al(OH)3 = Na[Al(OH)4],
или суммарно:
2Al + 6H2O + 2NaOH = Na[Al(OH)4] + 3Н2,
и в результате образуются алюминаты: Na[Al(OH)4] — алюминат натрия (тетрагидроксоалюминат натрия), К[Al(OH)4] — алюминат калия (терагидроксоалюминат калия) или др. Так как для атома алюминия в этих соединениях характерно координационное число 6, а не 4, то действительные формулы указанных тетрагидроксосоединений следующие: Na[Al(OH)4(Н2О)2] и К[Al(OH)4(Н2О)2].При нагревании алюминий реагирует с галогенами:
2Al + 3Cl2 = 2AlCl3,
2Al + 3 Br2 = 2AlBr3.
Интересно, что реакция между порошками алюминия и иода начинается при комнатной температуре, если в исходную смесь добавить несколько капель воды, которая в данном случае играет роль катализатора:2Al + 3I2 = 2AlI3.
Взаимодействие алюминия с серой при нагревании приводит к образованию сульфида алюминия:
2Al + 3S = Al2S3,
который легко разлагается водой:
Al2S3 + 6Н2О = 2Al(ОН)3 + 3Н2S.
С водородом алюминий непосредственно не взаимодействует, однако косвенными путями, например, с использованием алюминийорганических соединений, можно синтезировать твердый полимерный гидрид алюминия (AlН3)х — сильнейший восстановитель.В виде порошка алюминий можно сжечь на воздухе, причем образуется белый тугоплавкий порошок оксида алюминия Al2О3.
Высокая прочность связи в Al2О3 обусловливает большую теплоту его образования из простых веществ и способность алюминия восстанавливать многие металлы из их оксидов, например:
3Fe3O4 + 8Al = 4Al2O3 + 9Fe и даже
3СаО + 2Al = Al2О3 + 3Са.
Амфотерному оксиду Al2О3 соответствует амфотерный гидроксид — аморфное полимерное соединение, не имеющее постоянного состава. Состав гидроксида алюминия может быть передан формулой xAl2O3·yH2O, при изучении химии в школе формулу гидроксида алюминия чаще всего указывают как Аl(OH)3.
В лаборатории гидроксид алюминия можно получить в виде студенистого осадка обменными реакциями:
Al2(SO4)3 + 6NaOH = 2Al(OH)3 + 3Na2SO4,
или за счет добавления соды к раствору соли алюминия:
2AlCl3 + 3Na2CO3 + 3H2O = 2Al(OH)3↓ + 6NaCl + 3CO2,
а также добавлением раствора аммиака к раствору соли алюминия:
AlCl3 + 3NH3·H2O = Al(OH)3↓ + 3H2O + 3NH4Cl.
По масштабам применения алюминий и его сплавы занимают второе место после железа и его сплавов. Широкое применение алюминия в различных областях техники и быта связано с совокупностью его физических, механических и химических свойств: малой плотностью, коррозионной стойкостью в атмосферном воздухе, высокой тепло- и электропроводностью, пластичностью и сравнительно высокой прочностью. Алюминий легко обрабатывается различными способами — ковкой, штамповкой, прокаткой и др. Чистый алюминий применяют для изготовления проволоки (электропроводность алюминия составляет 65, 5% от электропроводности меди, но алюминий более чем в три раза легче меди, поэтому алюминий часто заменяет медь в электротехнике) и фольги, используемой как упаковочный материал. Основная же часть выплавляемого алюминия расходуется на получение различных сплавов. Сплавы алюминия отличаются малой плотностью, повышенной (по сравнению с чистым алюминием) коррозионной стойкостью и высокими технологическими свойствами: высокой тепло- и электропроводностью, жаропрочностью, прочностью и пластичностью. На поверхности сплавов алюминия легко наносятся защитные и декоративные покрытия.
Разнообразие свойств алюминиевых сплавов обусловлено введением в алюминий различных добавок, образующих с ним твердые растворы или интерметаллические соединения. Основную массу алюминия используют для получения легких сплавов — дуралюмина (94% Al, 4% Cu, по 0, 5% Mg, Mn, Fe и Si), силумина (85-90% Al, 10-14% Si, 0, 1% Na) и др. В металлургии алюминий используется не только как основа для сплавов, но и как одна из широко применяемых легирующих добавок в сплавах на основе меди, магния, железа, никеля и др.
Сплавы алюминия находят широкое применение в быту, в строительстве и архитектуре, в автомобилестроении, в судостроении, авиационной и космической технике. В частности, из алюминиевого сплава был изготовлен первый искусственный спутник Земли. Сплав алюминия и циркония — циркалой — широко применяют в ядерном реакторостроении. Алюминий применяют в производстве взрывчатых веществ.
Особо следует отметить окрашенные пленки из оксида алюминия на поверхности металлического алюминия, получаемые электрохимическим путем. Покрытый такими пленками металлический алюминий называют анодированным алюминием. Из анодированного алюминия, по внешнему виду напоминающему золото, изготовляют различную бижутерию.
При обращении с алюминием в быту нужно иметь в виду, что нагревать и хранить в алюминиевой посуде можно только нейтральные (по кислотности) жидкости (например, кипятить воду). Если, например, в алюминиевой посуде варить кислые щи, то алюминий переходит в пищу и она приобретает неприятный «металлический» привкус. Поскольку в быту оксидную пленку очень легко повредить, то использование алюминиевой посуды все-таки нежелательно.
В организм человека алюминий ежедневно поступает с пищей (около 2-3 мг), но его биологическая роль не установлена. В среднем в организме человека (70 кг) в костях, мышцах содержится около 60 мг алюминия.
- Беляев А. И. История алюминия, в сб. Труды Института истории естествознания и техники, т. 20, М., 1959.
- Беляев А. И. Металлургия легких металлов. М., 1970.
- Беляев А. И. Металлургия легких металлов. М., 1970.
- Промышленные алюминиевые сплавы. М., 1984.
megabook.ru
Алюминий
Получение алюмокалиевых квасцов
Алюминий (лат. Aluminium), – в периодической системе алюминий находится в третьем периоде, в главной подгруппе третьей группы. Заряд ядра +13. Электронное строение атома 1s22s22p63s23p1. Металлический атомный радиус 0,143 нм, ковалентный – 0,126 нм, условный радиус иона Al3+ – 0,057 нм. Энергия ионизации Al – Al+ 5,99 эВ.
Наиболее характерная степень окисления атома алюминия +3. Отрицательная степень окисления проявляется редко. Во внешнем электронном слое атома существуют свободные d-подуровни. Благодаря этому его координационное число в соединениях может равняться не только 4 (AlCl4-, AlH4-, алюмосиликаты), но и 6 (Al2O3, [Al(OH2)6]3+).
Историческая справка. Название Алюминий происходит от лат. alumen – так еще за 500 лет до н.э. назывались алюминиевые квасцы, которые применялись как протрава при крашении тканей и для дубления кожи. Датский ученый X. К. Эрстед в 1825, действуя амальгамой калия на безводный АlСl3 и затем отгоняя ртуть, получил относительно чистый Алюминий. Первый промышленного способ производства Алюминия предложил в 1854 французский химик А.Э. Сент-Клер Девиль: способ заключался в восстановлении двойного хлорида Алюминия и натрия Na3AlCl6 металлическим натрием. Похожий по цвету на серебро, Алюминий на первых порах ценился очень дорого. С 1855 по 1890 годы было получено всего 200 т Алюминия. Современный способ получения Алюминия электролизом криолитоглиноземного расплава разработан в 1886 году одновременно и независимо друг от друга Ч. Холлом в США и П. Эру во Франции.
Нахождение в природе
Алюминий – самый распространенный в земной коре металл. На его долю приходится 5,5–6,6 мол. доли% или 8 масс.%. Главная масса его сосредоточена в алюмосиликатах. Чрезвычайно распространенным продуктом разрушения образованных ими горных пород является глина, основной состав которой отвечает формуле Al2O3.2SiO2.2H2O. Из других природных форм нахождения алюминия наибольшее значение имеют боксит Al2O3.xH2O и минералы корунд Al2O3 и криолит AlF3.3NaF.
Получение
В настоящее время в промышленности алюминий получают электролизом раствора глинозема Al2O3 в расплавленнном криолите. Al2O3 должен быть достаточно чистым, поскольку из выплавленного алюминия примеси удаляются с большим трудом. Температура плавления Al2O3 около 2050оС, а криолита – 1100оС. Электролизу подвергают расплавленную смесь криолита и Al2O3, содержащую около 10 масс.% Al2O3, которая плавится при 960оС и обладает электрической проводимостью, плотностью и вязкостью, наиболее благоприятствующими проведению процесса. При добавлении AlF3, CaF2 и MgF2 проведение электролиза оказывается возможным при 950оС.
Электролизер для выплавки алюминия представляет собой железный кожух, выложенный изнутри огнеупорным кирпичом. Его дно (под), собранное из блоков спрессованного угля, служит катодом. Аноды располагаются сверху: это – алюминиевые каркасы, заполненные угольными брикетами.
Al2O3 = Al3+ + AlO33-
На катоде выделяется жидкий алюминий:
Al3+ + 3е— = Al
Алюминий собирается на дне печи, откуда периодически выпускается. На аноде выделяется кислород:
4AlO33- – 12е— = 2Al2O3 + 3O2
Кислород окисляет графит до оксидов углерода. По мере сгорания углерода анод наращивают.
Алюминий, кроме того, применяется как легирующая добавка ко многим сплавам для придания им жаростойкости.
Физические свойства алюминия. Алюминий сочетает весьма ценный комплекс свойств: малую плотность, высокие теплопроводность и электрическую проводимость, высокую пластичность и хорошую коррозионную стойкость. Он легко поддается ковке, штамповке, прокатке, волочению. Алюминий хорошо сваривается газовой, контактной и других видами сварки. Решетка Алюминия кубическая гранецентрированная с параметром а = 4,0413 Å. Свойства Алюминий, как и всех металлов, в значит, степени зависят от его чистоты. Свойства Алюминия особой чистоты (99,996%): плотность (при 20 °С) 2698,9 кг/м3; tпл 660,24 °С; tкип около 2500 °С; коэффициент термического расширения (от 20° до 100 °С) 23,86·10-6; теплопроводность (при 190 °С) 343 вт/м·К [0,82 кал/(см·сек·°С)], удельная теплоемкость (при 100 °С) 931,98 дж/кг·К. [0,2226 кал/(г·°С)]; электропроводность по отношению к меди (при 20 °С) 65,5%. Алюминий обладает невысокой прочностью (предел прочности 50–60 Мн/м2), твердостью (170 Мн/м2 по Бринеллю) и высокой пластичностью (до 50%). При холодной прокатке предел прочности Алюминия возрастает до 115 Мн/м2, твердость – до 270 Мн/м2, относительное удлинение снижается до 5% (1 Мн/м2~ и 0,1 кгс/мм2). Алюминий хорошо полируется, анодируется и обладает высокой отражательной способностью, близкой к серебру (он отражает до 90% падающей световой энергии). Обладая большим сродством к кислороду, Алюминий на воздухе покрывается тонкой, но очень прочной пленкой оксида Al2О3, защищающей металл от дальнейшего окисления и обусловливающей его высокие антикоррозионные свойства. Прочность оксидной пленки и защитное действие ее сильно убывают в присутствии примесей ртути, натрия, магния, меди и др. Алюминий стоек к действию атмосферной коррозии, морской и пресной воды, практически не взаимодействует с концентрированной или сильно разбавленной азотной кислотой, с органических кислотами, пищевыми продуктами.
Химические свойства
При накаливании мелко раздробленного алюминия он энергично сгорает на воздухе. Аналогично протекает и взаимодействие его с серой. С хлором и бромом соединение происходит уже при обычной температуре, с иодом – при нагревании. При очень высоких температурах алюминий непосредственно соединяется также с азотом и углеродом. Напротив, с водородом он не взаимодействует.
По отношению к воде алюминий вполне устойчив. Но если механическим путем или амальгамированием снять предохраняющее действие оксидной пленки, то происходит энергичная реакция:
2Al + 6H2O = 2Al(OH)3 + 3H2
Сильно разбавленные, а также очень концентрированные HNO3 и h3SO4 на алюминий почти не действуют (на холоду), тогда как при средних концентрациях этих кислот он постепенно растворяется. Чистый алюминий довольно устойчив и по отношению к соляной кислоте, но обычный технический металл в ней растворяется.
При действии на алюминий водных растворов щелочей слой оксида растворяется, причем образуются алюминаты – соли, содержащие алюминий в составе аниона:
Al2O3 + 2NaOH + 3H2O = 2Na [Al(OH)4]
Алюминий, лишенный защитной пленки, взаимодействует с водой, вытесняя из нее водород:
2Al + 6H2O = 2Al(OH)3 + 3H2
Образующийся гидроксид алюминия реагирует с избытком щелочи, образуя гидроксоалюминат:
Al(OH)3 + NaOH = Na [Al(OH)4]
Суммарное уравнение растворения алюминия в водном растворе щелочи:
2Al + 2NaOH + 6H2O = 2Na [Al(OH)4] + 3H2
Алюминий заметно растворяется в растворах солей, имеющих вследствие их гидролиза кислую или щелочную реакцию, например, в растворе Na2CO3.
В ряду напряжений он располагается между Mg и Zn. Во всех своих устойчивых соединениях алюминий трехвалентен.
Соединение алюминия с кислородом сопровождается громадным выделением тепла (1676 кДж/моль Al2O3), значительно большим, чем у многих других металлов. В виду этого при накаливании смеси оксида соответствующего металла с порошком алюминия происходит бурная реакция, ведущая к выделению из взятого оксида свободного металла. Метод восстановления при помощи Al (алюмотермия) часто применяют для получения ряда элементов (Cr, Mn, V, W и др.) в свободном состоянии.
Алюмотермией иногда пользуются для сварки отдельных стальных частей, в часности стыков трамвайных рельсов. Применяемая смесь («термит») состоит обычно из тонких порошков алюминия и Fe3O4. Поджигается она при помощи запала из смеси Al и BaO2. Основная реакция идет по уравнению:
8Al + 3Fe3O4 = 4Al2O3 + 9Fe + 3350 кДж
Причем развивается температура около 3000оС.
Оксид алюминия представляет собой белую, очень тугоплавкую (т. пл. 2050оС) и нерастворимую в воде массу. Природный Al2O3 (минерал корунд), а также полученный искусственно и затем сильно прокаленный отличается большой твердостью и нерастворимостью в кислотах. В растворимое состояние Al2O3 (т. н. глинозем) можно перевести сплавлением со щелочами.
Обычно загрязненный оксидом железа природный корунд вследствие своей чрезвычайной твердости применяется для изготовления шлифовальных кругов, брусков и т.д. В мелко раздробленном виде он под названием наждака служит для очистки металлических поверхностей и изготовления наждачной бумаги. Для тех же целей часто пользуются Al2O3, получаемым сплавлением боксита (техническое название – алунд).
Прозрачные окрашеннные кристаллы корунда – красный рубин – примесь хрома – и синий сапфир – примесь титана и железа – драгоценные камни. Их получают так же искусственно и используют для технических целей, например, для изготовления деталей точных приборов, камней в часах и т.п. Кристаллы рубинов, содержащих малую примесь Cr2O3, применяют в качестве квантовых генераторов – лазеров, создающих направленный пучок монохроматического излучения.
Ввиду нерастворимости Al2O3 в воде отвечающий этому оксиду гидроксид Al(OH)3 может быть получен лишь косвенным путем из солей. Получение гидроксида можно представить в виде следующей схемы. При действии щелочей ионами OH – постепенно замещаются в аквокомплексах [Al(OH2)6]3+ молекулы воды:
[Al(OH2)6]3+ + OH— = [Al(OH) (OH2)5]2+ + H2O
[Al(OH) (OH2)5]2+ + OH— = [Al(OH)2(OH2)4]+ + H2O
[Al(OH)2(OH2)4]+ + OH— = [Al(OH)3(OH2)3]0 + H2O
Al(OH)3 представляет собой объемистый студенистый осадок белого цвета, практически нерастворимый в воде, но легко растворяющийся в кислотах и сильных щелочах. Он имеет, следовательно, амфотерный характер. Однако и основные и особенно кислотные его свойства выражены довольно слабо. В избытке NH4OH гидроксид алюминия нерастворим. Одна из форм дегидратированного гидроксида – алюмогель используется в технике в качестве адсорбента.
При взаимодействии с сильными щелочами образуются соответствующие алюминаты:
NaOH + Al(OH)3 = Na [Al(OH)4]
Алюминаты наиболее активных одновалентных металлов в воде хорошо растворимы, но ввиду сильного гидролиза растворы их устойчивы лишь при наличии достаточного избытка щелочи. Алюминаты, производящиеся от более слабых оснований, гидролизованы в растворе практически нацело и поэтому могут быть получены только сухим путем (сплавлением Al2O3 с оксидами соответствующих металлов). Образуются метаалюминаты, по своему составу производящиеся от метаалюминиевой кислоты HAlO2. Большинство из них в воде нерастворимо.
С кислотами Al(OH)3 образует соли. Производные большинства сильных кислот хорошо растворимы в воде, но довольно значительно гидролизованы, и поэтому растворы их показывают кислую реакцию. Еще сильнее гидролизованы растворимые соли алюминия и слабых кислот. Вследствие гидролиза сульфид, карбонат, цианид и некоторые другие соли алюминия из водных растворов получить не удается.
В водной среде анион Al3+ непосредственно окружен шестью молекулами воды. Такой гидратированный ион несколько диссоциирован по схеме:
[Al(OH2)6]3+ + H2O = [Al(OH) (OH2)5]2+ + OH3+
Константа его диссоциации равна 1.10-5, т.е. он является слабой кислотой (близкой по силе к уксусной). Октаэдрическое окружение Al3+ шестью молекулами воды сохраняется и в кристаллогидратах ряда солей алюминия.
Алюмосиликаты можно рассматривать как силикаты, в которых часть кремниекислородных тетраэдров SiO44 – заменена на алюмокислородные тетраэдры AlO45- Из алюмосиликатов наиболее распространены полевые шпаты, на долю которых приходится более половины массы земной коры. Главные их представители – минералы
ортоклаз K2Al2Si6O16 или K2O.Al2O3.6SiO2
альбит Na2Al2Si6O16 или Na2O.Al2O3.6SiO2
анортит CaAl2Si2O8 или CaO.Al2O3.2SiO2
Очень распространены минералы группы слюд, например мусковит Kal2(AlSi3O10) (OH)2. Большое практическое значение имеет минерал нефелин (Na, K)2[Al2Si2O8], который используется для получения глинозема содовых продуктов и цемента. Это производство складывается из следующих операций: a) нефелин и известняк спекают в трубчатых печах при 1200оС:
(Na, K)2[Al2Si2O8] + 2CaCO3 = 2CaSiO3 + NaAlO2 + KAlO2 + 2CO2
б) образовавшуюся массу выщелачивают водой – образуется раствор алюминатов натрия и калия и шлам CaSiO3:
NaAlO2 + KAlO2 + 4H2O = Na [Al(OH)4] + K [Al(OH)4]
в) через раствор алюминатов пропускают образовавшийся при спекании CO2:
Na [Al(OH)4] + K [Al(OH)4] + 2CO2 = NaHCO3 + KHCO3 + 2Al(OH)3
г) нагреванием Al(OH)3 получают глинозем:
2Al(OH)3 = Al2O3 + 3H2O
д) выпариванием маточного раствора выделяют соду и потаж, а ранее полученный шлам идет на производство цемента.
При производстве 1 т Al2O3 получают 1 т содопродуктов и 7.5 т цемента.
Некоторые алюмосиликаты обладают рыхлой структурой и способны к ионному обмену. Такие силикаты – природные и особенно искусственные – применяются для водоумягчения. Кроме того, благодаря своей сильно развитой поверхности, они используются в качестве носителей катализаторов, т.е. как материалы, пропитываемые катализатором.
Галогениды алюминия в обычных условиях – бесцветные кристаллические вещества. В ряду галогенидов алюминия AlF3 сильно отличается по свойствам от своих аналогов. Он тугоплавок, мало растворяется в воде, химически неактивен. Основной способ получения AlF3 основан на действии безводного HF на Al2O3 или Al:
Al2O3 + 6HF = 2AlF3 + 3H2O
Соединения алюминия с хлором, бромом и иодом легкоплавки, весьма реакционноспособны и хорошо растворимы не только в воде, но и во многих органических растворителях. Взаимодействие галогенидов алюминия с водой сопровождается значительным выделением теплоты. В водном растворе все они сильно гидролизованы, но в отличие от типичных кислотных галогенидов неметаллов их гидролиз неполный и обратимый. Будучи заметно летучими уже при обычных условиях, AlCl3, AlBr3 и AlI3 дымят во влажном воздухе (вследствие гидролиза). Они могут быть получены прямым взаимодействием простых веществ.
Плотности паров AlCl3, AlBr3 и AlI3 при сравнительно невысоких температурах более или менее точно соответствуют удвоенным формулам – Al2Hal6. Пространственная структура этих молекул отвечает двум тетраэдрам с общим ребром. Каждый атом алюминия связан с четырьмя атомами галогена, а каждый из центральных атомов галогена – с обоими атомами алюминия. Из двух связей центрального атома галогена одна является донорно-акцепторной, причем алюминий функционирует в качестве акцептора.
С галогенидными солями ряда одновалентных металлов галогениды алюминия образуют комплексные соединения, главным образом типов M3[AlF6] и M[AlHal4] (где Hal – хлор, бром или иод). Склонность к реакциям присоединения вообще сильно выражена у рассматриваемых галогенидов. Именно с этим связано важнейшее техническое применение AlCl3 в качестве катализатора (при переработке нефти и при органических синтезах).
Из фторалюминатов наибольшее применение (для получения Al, F2, эмалей, стекла и пр.) имеет криолит Na3[AlF6]. Промышленное производство искусственного криолита основано на обработке гидроксида алюминия плавиковой кислотой и содой:
2Al(OH)3 + 12HF + 3Na2CO3 = 2Na3[AlF6] + 3CO2 + 9H2O
Хлоро-, бромо- и иодоалюминаты получаются при сплавлении тригалогенидов алюминия с галогенидами соответствующих металлов.
Хотя с водородом алюминий химически не взаимодействует, гидрид алюминия можно получить косвенным путем. Он представляет собой белую аморфную массу состава (AlH3)n. Разлагается при нагревании выше 105оС с выделением водорода.
При взаимодействии AlH3 с основными гидридами в эфирном растворе образуются гидроалюминаты:
LiH + AlH3 = Li[AlH4]
Гидридоалюминаты – белые твердые вещества. Бурно разлагаются водой. Они – сильные восстановители. Применяются (в особенности Li[AlH4]) в органическом синтезе.
Сульфат алюминия Al2(SO4)3.18H2O получается при действии горячей серной кислоты на оксид алюминия или на каолин. Применяется для очистки воды, а также при приготовлении некоторых сортов бумаги.
Алюмокалиевые квасцы KAl(SO4)2.12H2O применяются в больших количествах для дубления кож, а также в красильном деле в качестве протравы для хлопчатобумажных тканей. В последнем случае действие квасцов основано на том, что образующиеся вследствие их гидролиза гидроксид алюминия отлагается в волокнах ткани в мелкодисперсном состоянии и, адсордбируя краситель, прочно удерживает его на волокне.
Из остальных производных алюминия следует упомянуть его ацетат (иначе – уксуснокислую соль) Al(CH3COO)3, используемый при крашении тканей (в качестве протравы) и в медицине (примочки и компрессы). Нитрат алюминия легко растворим в воде. Фосфат алюминия нерастворим в воде и уксусной кислоте, но растворим в сильных кислотах и щелочах.
Алюминий в организме. Алюминий входит в состав тканей животных и растений; в органах млекопитающих животных обнаружено от 10-3 до 10-5% Алюминия (на сырое вещество). Алюминий накапливается в печени, поджелудочной и щитовидной железах. В растительных продуктах содержание Алюминия колеблется от 4 мг на 1 кг сухого вещества (картофель) до 46 мг (желтая репа), в продуктах животного происхождения – от 4 мг (мед) до 72 мг на 1 кг сухого вещества (говядина). В суточном рационе человека содержание алюминия достигает 35–40 мг. Известны организмы – концентраторы алюминия, например, плауны (Lycopodiaceae), содержащие в золе до 5,3% алюминия, моллюски (Helix и Lithorina), в золе которых 0,2–0,8% алюминия. Образуя нерастворимые соединения с фосфатами, алюминий нарушает питание растений (поглощение фосфатов корнями) и животных (всасывание фосфатов в кишечнике).
Геохимия алюминия. Геохимические черты алюминия определяются его большим сродством к кислороду (в минералах алюминий входит в кислородные октаэдры и тетраэдры), постоянной валентностью (3), слабой растворимостью большинства природных соединений. В эндогенных процессах при застывании магмы и формировании изверженных пород алюминий входит в кристаллическую решетку полевых шпатов, слюд и других минералов – алюмосиликатов. В биосфере алюминий – слабый мигрант, его мало в организмах и гидросфере. Во влажном климате, где разлагающиеся остатки обильной растительности образуют много органических кислот, алюминий мигрирует в почвах и водах в виде органоминеральных коллоидных соединений; алюминий адсорбируется коллоидами и осаждается в нижней части почв. Связь алюминия с кремнием частично нарушается и местами в тропиках образуются минералы – гидрооксиды алюминия – бемит, диаспор, гидраргиллит. Большая же часть алюминия входит в состав алюмосиликатов – каолинита, бейделлита и других глинистых минералов. Слабая подвижность определяет остаточное накопление алюминия в коре выветривания влажных тропиков. В результате образуются элювиальные бокситы. В прошлые геологические эпохи бокситы накапливались также в озерах и прибрежной зоне морей тропических областей (например, осадочные бокситы Казахстана). В степях и пустынях, где живого вещества мало, а воды нейтральные и щелочные, алюминий почти не мигрирует. Наиболее энергична миграция алюминия в вулканических областях, где наблюдаются сильнокислые речные и подземные воды, богатые алюминием. В местах смещения кислых вод с щелочными – морскими (в устьях рек и других), алюминий осаждается с образованием бокситовых месторождений.
Применение Алюминия. Сочетание физических, механических и химических свойств Алюминия определяет его широкое применение практически во всех областях техники, особенно в виде его сплавов с других металлами. В электротехнике Алюминий успешно заменяет медь, особенно в производстве массивных проводников, например, в воздушных линиях, высоковольтных кабелях, шинах распределительных устройств, трансформаторах (электрическая проводимость Алюминия достигает 65,5% электрической проводимости меди, и он более чем в три раза легче меди; при поперечном сечении, обеспечивающем одну и ту же проводимость, масса проводов из Алюминий вдвое меньше медных). Сверхчистый Алюминий употребляют в производстве электрических конденсаторов и выпрямителей, действие которых основано на способности оксидной пленки Алюминия пропускать электрический ток только в одном направлении. Сверхчистый Алюминий, очищенный зонной плавкой, применяется для синтеза полупроводниковых соединений типа АIII BV, применяемых для производства полупроводниковых приборов. Чистый Алюминий используют в производстве разного рода зеркальных отражателей. Алюминий высокой чистоты применяют для предохранения металлических поверхностей от действия атмосферной коррозии (плакирование, алюминиевая краска). Обладая относительно низким сечением поглощения нейтронов, Алюминий применяется как конструкционный материал в ядерных реакторах.
В алюминиевых резервуарах большой емкости хранят и транспортируют жидкие газы (метан, кислород, водород и т.д.), азотную и уксусную кислоты, чистую воду, перекись водорода и пищевые масла. Алюминий широко применяют в оборудовании и аппаратах пищевой промышленности, для упаковки пищевых продуктов (в виде фольги), для производства разного рода бытовых изделий. Резко возросло потребление Алюминий для отделки зданий, архитектурных, транспортных и спортивных сооружений.
В металлургии Алюминий (помимо сплавов на его основе) – одна из самых распространенных легирующих добавок в сплавах на основе Сu, Mg, Ti, Ni, Zn и Fe. Применяют Алюминий также для раскисления стали перед заливкой ее в форму, а также в процессах получения некоторых металлов методом алюминотермии. На основе Алюминия методом порошковой металлургии создан САП (спеченный алюминиевый порошок), обладающий при температурах выше 300 °С большой жаропрочностью.
Алюминий используют в производстве взрывчатых веществ (аммонал, алюмотол). Широко применяют различные соединения Алюминия.
Производство и потребление Алюминия непрерывно растет, значительно опережая по темпам роста производство стали, меди, свинца, цинка.
Список использованной литературы
1. В.А. Рабинович, З.Я. Хавин «Краткий химический справочник»
2. Л.С. Гузей «Лекции по общей химии»
3. Н.С. Ахметов «Общая и неорганическая химия»
4. Б.В. Некрасов «Учебник общей химии»
5. Н.Л. Глинка «Общая химия»
studfile.net
